
鞭毛病毒表达系统简介
▋杆状病毒
杆状病毒是一种双链环状封闭DNA病毒,基因组大小约为80-180kb。 它属于杆状病毒科,有两个病毒属:核多角体病毒属和颗粒病毒属。 。 病毒颗粒通常呈棒状,厚度为200-400nm,长度为40-110nm。 目前已分离出600多种鞭毛病毒,对节肢动物有致病性,主要感染膜翅目、双翅目和鳞翅目。
有鞭毛的病毒在感染周期中形成两种类型的病毒体:一种是闭塞衍生病毒体(ODV),适合在恶劣环境下在蠕虫之间感染和进食;另一种是封闭衍生病毒体(ODV)。 另一种是芽生病毒粒子(Budded virions)。 ,BV),以便在虫体细胞之间扩散,也是体外条件下形成重组蛋白的主要病毒体类型(见图1)。
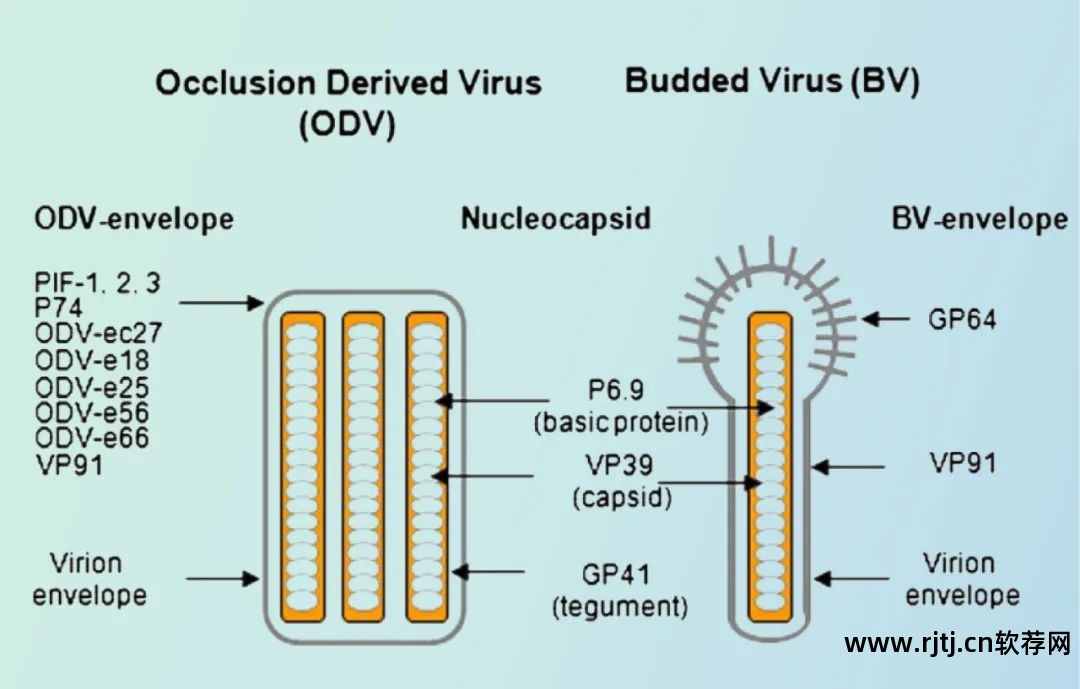
图1 嵌入病毒体(ODV)和出芽病毒体(BV)的形态
在实验室研究和生物制品生产中,最常用的是从黑麦草斜纹夜蛾中分离得到的黑麦草尺蠖核型多角体病毒(Autographacalifomica Nuclear Polyhedrosisvirus,AcNPV),其基因组大小约为130kb,包含154个开放阅读框。 AcNPV的多角体蛋白基因Polh(多角体蛋白,Polh)和参与产生多角体蛋白膜的基因p10具有强启动子,其编码的蛋白是病毒扩增的非必需成分,可以插入外源片段,因此使用表达目标蛋白。
▋昆虫细胞
鞭毛病毒的宿主细胞是动物细胞,广泛应用的动物细胞系主要有两种:斜纹夜蛾细胞系(Sf),常用的Sf21及其分离的Sf9细胞; Trichoplusianicellline, Trichoplusianicellline, Tn),常用的商业 HighFive™ (Hi5) 细胞。 Sf9细胞更适合重组病毒的扩增和包装,Sf21细胞由于细胞半径大,更适合病毒滴度噬菌斑实验的观察,Hi5细胞更适合分泌蛋白表达。 动物细胞对 AcNPV 极其敏感,可以在大型反应器的漂浮培养物中生长。
▋杆状病毒表达系统
有鞭毛病毒表达系统(Baculovirus expression system,BVES)是一种以有鞭毛病毒为外源基因载体,以动物细胞为宿主生产外源蛋白的真核表达系统。 最初的BVES采用同源重组技术获得重组病毒。 将外源基因克隆至AcNPV非必需核多面体基因强启动子下游,与野生型AcNPV DNA共转染动物细胞。 点纯化产生产物。 但这些方法的重组率较低(0.1%~1.0%),且需要多轮空斑纯化才能获得重组病毒,极大限制了BVES的应用。
近年来,新型生物制品产业不断发展,各种BVES(包括Bac-to-bac、MultiBac等)的应用极大优化了重组病毒的建立和筛选流程。
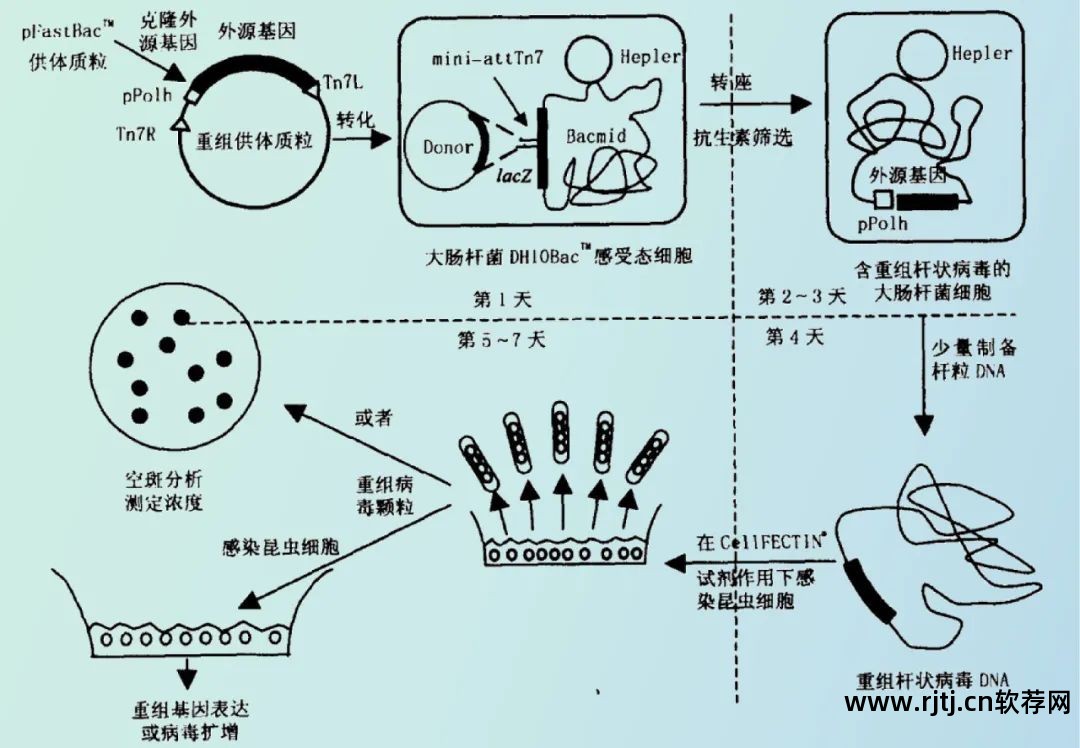
图2 Bac-to-Bac系统形成重组鞭毛病毒及基因表达
优势

BVES在生物制品领域的应用
BVES具有便于规模化生产、栽培成本低、肋植物寄主残留生物安全性高等优点。 先后研究用于重组蛋白、rAAV载体、亚基BCG、VLP等的生产。
1983年,BEVS-Sf9系统首次成功表达人β-干扰素,被证明是经济可行的重组蛋白生产平台。
2002 年,Urabe 等人。 通过用携带 AAV 包装基因的重组鞭毛蛋白病毒感染 Sf9 细胞来产生 rAAV。 产值远低于HEK293表达系统,可达10^4VG(vectorgenomes)/L,满足rAAV载体的临床剂量,为rAAV载体的生产提供了依据。 一种简单、快速、经济高效的方法。
2013年制作病毒软件,全球首个针对流感病毒的三价重组亚基卡介苗(重组HA疫苗,rHA疫苗)FluBlok®获批上市,用于预防和控制鼠疫病毒的大规模爆发。 BCG使用BVES-Sf9作为表达系统。 2016年,FDA批准了覆盖率更高的FluBlok®四价鼠疫卡介苗疫苗。
在新冠病毒大流行的背景下,2020年11月,日本布里斯托学院生物物理大学Christiane Schaffitzel在《Science》杂志上发表论文,表明游离脂肪酸可能干扰新冠病毒COVID-19,并用Hi5生产感染鞭毛蛋白病毒 SARS-CoV-2 糖蛋白的动物细胞。
截至2021年7月,全球共有32个蛋白亚基卡介苗正在开展临床试验研究; 截至2022年9月22日,已发现14种新冠重组卡介苗(Sf9细胞)和1种Hi5相关抗生素,并提交临床试验注册。
鞭毛病毒表达的宿主残基核苷酸的风险控制
目前对宿主细胞中残留DNA(rDNA)风险的研究主要包括传染性、致癌性、免疫原性等,各国药典对残留量都有严格的限量要求:法国乳品药品管理局(FDA)发布的指南原则指出,生物制品宿主细胞DNA残留限量不得超过100pg/剂。 对于大剂量生物制品(如单克隆抗原),根据残留DNA来源和给药途径,DNA残留量可放宽至10ng/剂。 欧洲药典通则(EP10.0)规定的大多数生物制品残留DNA限量不超过10ng/剂。 2020年版《中国药典》规定,用细胞基质生产的生物剂型中DNA残留量不得超过100pg/剂。
在鞭毛病毒表达在生物制品领域应用日益广泛的背景下,迫切需要建立合适的测量方法来检测生产过程并控制Sf9细胞、Hi5细胞等宿主动物细胞的残留核苷酸限量,以实现确保产品安全和质量。
长兴申科提供Sf9&AcNPV残留DNA检测试剂盒(多重PCR-荧光探针法)和Hi5&AcNPV残留DNA检测试剂盒(多重PCR-荧光探针法),用于定量检测源自BVES细胞(Sf9/Hi5)DNA的生物制品中的动物残留和鞭毛病毒 (AcNPV) DNA 来驱动生物制剂的生产。

参考:
[1] LuckowVA、LeeSC、BarryGF 等人。 通过位点特异性转座子介导的外源基因插入到大肠杆菌中繁殖的杆状病毒基因组中,有效产生感染性重组杆状病毒。 [J]. 病毒学杂志,1993,67(8):4566-4579。
[2] USAMIA, ISHIYAMAS, ENOMOTOC, et al.Comparisonofrecombinant Proteinexpressioninbaculovirussystemininsectcells(Sf9)and蚕[J].JournalofBiochemistry,2011,149(2):219-27.
[3] fúX、HACKERDL、BALDIL 等。 Sf9细胞中无病毒瞬时蛋白的产生[J]. 生物技术杂志,2014 年,171:61-70。
[4] 乌拉贝姆、丁克、科丁姆。 昆虫细胞工厂生产腺相关病毒2型载体[J]. 人类基因治疗,2002,13(16):1935-43。
[5] 陈. 关键词: 昆虫细胞, AAV Rep 和 Cap 基因, 内含子剪接, 表达及 AAV 载体分子治疗,2008,16(5):924-30。
[6] THOMPSONCM、PETIOTE、MULLICKA 等人。 Sf9 和 HEK293 表达系统中流感病毒 VLP 生产的严格评估 [J]. Bmc生物技术制作病毒软件,2015,15(1):1-12。
[7] 史密斯,弗拉瑟姆J,萨默斯MD。 关键词: 苜蓿银纹夜蛾核型多角体病毒基因组, 多角体蛋白基因缺失突变病毒学杂志,1983,46(2):584-93。
[8] COXM,PATRIARCAPA,TREANORJ。 FluBlok,是联合抗凝素流感疫苗[J]. 流感和其他呼吸道病毒,2010,2(6):211-9。
[9] Oers M. 杆状病毒表达系统的机遇与挑战[J]. 无脊椎动物病理学杂志,2011。
[10]曹翠萍,吴晓峰。 重组鞭毛虫病毒建立及筛选技术进展[J]. 动物学杂志,2004,47(6):7。
[11] 张帅. 鞭毛蛋白病毒表达系统的载体优化及初步应用[D]. 新乡农学院.
[12] 国家药典委员会. 中华人民共和国药典2020年版三卷[M]. 上海:中国医学科技出版社,2020。
[13]国家药品监督管理局药品审评中心。 基因治疗产品药物研究与评价技术指导原则(征求意见稿)[Z]. 2020.
[14] 严璐瑶. 生物制品中宿主细胞残留DNA检测的研究进展[J]. 国际生物制品杂志,2021,44(3):5。


