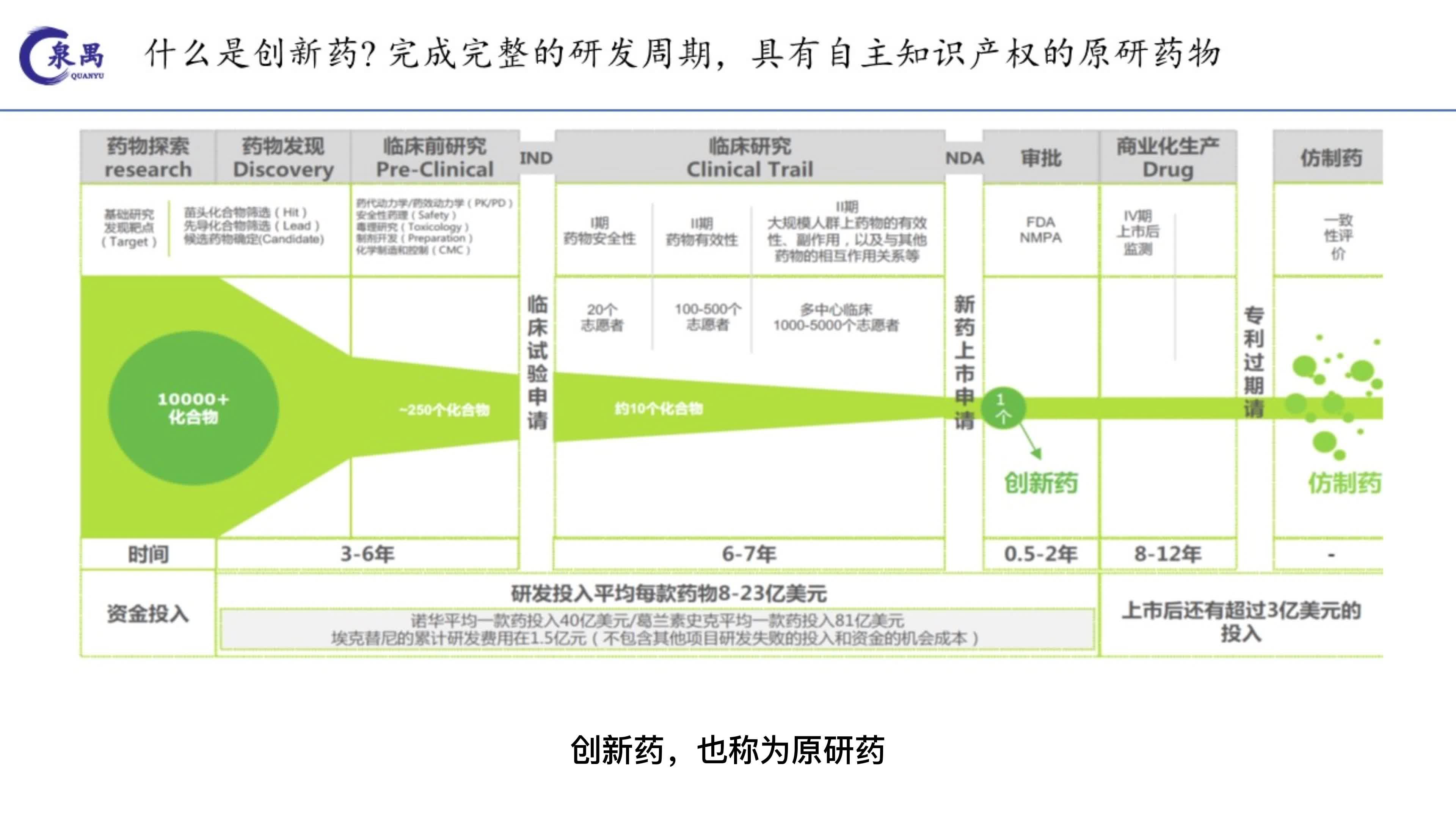
数据显示,近十年来,我国新药研发前20名靶点的产品申请数量为716件,占比29%。同质化、内卷化亟待解决。
刚刚过去的第三季度,一些数据似乎透露出我国创新药行业良好发展的迹象。
首先,根据华孚证券精选的23家A股创新药公司业绩统计,2024年Q3营收48.4亿元,同比增长34%,归属于母公司的净亏损母公司利润16.9亿元,同比下降13.%。
其次,信银国际(香港)资本研究部统计数据显示,创新药IND、NDA数量在2022年低点后已恢复增长。今年三季度临床批准药物1033个,同比增长25%,一类创新药获批。共有8个上市项目,同比翻倍。信银国际(香港)资本研究部认为,国产创新药正在加速进入“新的质量发展阶段”。
然而“硬币”的另一面也表明,我国创新药产业实际上处于高度同质化、内卷化的状态。
17日在上海举行的“2024第二届浦江生物医药源头创新论坛”(以下简称“源头创新论坛”)上,中国工程院院士、上海材料研究所研究员丁健发表讲话中科院Medica披露的一组数据显示,近十年来,我国新药研发前20名靶标共有716个产品申报,占比高达29%。以2019年为例,我国70%的临床创新药产品集中在21%的靶点上。
“中国是全球第二大创新生物医药国家,但我们只占全球创新药销售市场的3%。”中国医药创新促进会执行会长宋瑞林甚至指出了中国创新药的另一面。一个痛处。
这些问题背后反映出的残酷事实是,我国医药行业的创新能力特别是源头创新能力仍有待提高。真正思考这些问题,或许能为中国创新药产业的发展提供动力。
此外,在当前受医保和集采控费影响的背景下,中国创新药企摆脱动力不足局面的有效途径之一无疑是“借船出海”。
源头创新不同路径的思考
在源头创新论坛上,丁健表示,中国的癌症发病率,无论是新发病例还是死亡病例,都占到了全球的三分之一,并且还在持续增长,因此中国的抗癌药物研发速度是最快的。 。
“有一个趋势,近年来,我们批准的抗肿瘤新药数量在逐渐增加。2023年,国家药品监督管理局(NMPA)批准了13个国产抗肿瘤新药和12个进口抗肿瘤新药。 2024年上半年,两者分别是11个和3个,从数量上看,我们正在追赶。”丁健透露。
但同时,在他看来,由于缺乏原创理论和原创技术,中国很难生产原创新药。 “一个理论出现后,往往会产生一批新药。我们经常讲first-in-class(FIC),但目前还没有一种药物得到国际认可,产生显着的社会和影响。”经济效益。”
他在演讲中展示的另一组数据显示,从2013年到2022年这十年间,美国、中国、日本和欧洲的原创新药中,美国占69.1%,欧盟占16.1%,日本占13.0%。中国仅占1.8%。 “我国在新药研发相关技术方面基本落后,原创新药不可能天天生产。”
在丁健看来,创新是有不同层次的。目前,快速跟随是实现原始创新的主要方式。 “在原始创新的过程中,我们要有孜孜不倦、执着追求的理念。”
数据显示,fast-follow是指基于FIC药物的仿创新,在不侵犯他人专利的情况下,在现有靶点和机制的基础上,对新药的分子结构进行改造或修改,寻找相同或相似的机制的行动。新药具有新的治疗效果。
丁健通过两个例子来解释快速跟随。其中之一传奇生物通过与强生公司合作开发了BCMA CAR-T细胞疗法。 “实际上,我们并不是第一个 BCMA。结果公布后,美国多家细胞治疗生物技术公司暂停了BCMA治疗多发性骨髓瘤的所有研究。这是一个完整的优势。”此外,百济神州不仅研发了BTK抑制剂zanubrutinib,还在与ibrutinib的头对头对比研究中击败了对方。
相比之下,宋瑞林认为,中医药的源头创新和产业创新急需政策支持。
“其实这个行业本身并不需要政府太多的资助,我们希望政策能够宽松一些。”宋瑞林认为,如果我们的市场环境不改变,投资者就不会来,耐心的资本需要长期的信任。 “没有完整的市场,就不可能有繁荣的产业。”他说。
另一方面,他认为仿制药和创新药应该有所区别。 “仿制药是公共产品,人们必须确保买得起。创新药物必须在人们需要时提供给他们。”他表示,现行医保目录继A目录、B目录之后,急需C目录。
“只要能把目前创新药在医保谈判中的定价改为付费价格,只要能给中国医疗领域一个自付费用药品的市场,我们公司就可以在市场上展现自己的价值,不进医保就面临赔钱的前景,不进医院就没办法发展。”
最后,宋瑞林还提醒,中国不能仅依靠医疗保险来支持创新。 “怎么办?一定要给企业预留空间,商业保险的独立保障体系,未来将成为创新生物药的一个大市场。”
“借船出海”仍是解决问题的办法
如果说,思考源头创新之路,将为未来中国创新药的发展铺平道路。所以,既然意识到了自身创新能力的局限性,中国生物科技企业实现快速发展的有效途径或许仍是“借船出海”。
华源证券指出,近年来,国内药企研发同质化问题逐渐显现,竞争日趋激烈,医保谈判压力下的生存迫使越来越多的药企开始拓展海外市场。由于海外定价高、空间大,真正具有创新价值的国产新药有望在海外获得广阔的发展空间和丰厚的回报。

同样,在源头创新论坛上,BCG董事总经理吴纯以百济神州的zanubrutinib为例。以2024年上半年为例,扎鲁替尼全球超过80亿元的销售额中,近60亿元来自美国市场,超过10亿来自欧洲市场,中国市场贡献不足9亿元。
“我们一直在问,中国药企对于一个创新药,尤其是具有best-in-class、me-better资质的药物,天花板有多高。我们觉得可能只有30亿左右。”吴纯表示,“目前,受各类医保和集中采购费用管制的影响,中国创新药企业仍然要到海外去解决问题。”
事实上,近年来,中国药企的BD状态已从License-in转向License-out,出海趋势日益盛行。
据医立方统计,国内药企的许可引进项目数量在2021年达到峰值151个,随后迅速回落至2023年的57个。相比之下,许可许可项目数量逐年增加,从2021年的45家增加到2023年的96家,2024年前三季度已经有70家左右。
进入四季度后,国内药企出海热情依然高涨。
今年10月7日,石药集团宣布将Lpa小分子抑制剂YS2302018的全球权利授权给阿斯利康。后者支付预付款1亿美元,里程碑付款19.2亿美元,交易总价值20.2亿美元。 11月14日,默沙东获得立新药业研发的PD-1/VEGF双特异性抗体LM-299的全球独家授权。加上首付款和里程碑付款,立新药业预计将获得最高总交易金额32.88亿美元。近238亿元。
随后11月18日,成帆药业宣布将Nectin4/TROP2双特异性抗体药物偶联物(ADC)授予Avenzo,潜在交易价值8亿美元,折合人民币约58亿元。同日,Biosyn宣布将新型抗TSLP单克隆抗体BSI-045B和新型抗TSLP/IL4R双特异性抗体BSI-502授权给Aclaris。潜在交易总额超过9.4亿美元,折合人民币约68亿元。同时,Booxin还将获得Aclaris 19.9%的股权。
针对出海问题,复星医药董事长吴以芳在源头创新论坛上表示,经过30年的发展,复星医药已发展成为中国制药企业前四强。近年来,公司创新药销售加速。
他透露,在国际化方面,复星医药计划在未来两年内完成全球主要市场运营能力从0到1的全面实现,包括仿制药和创新药。 “同时,复星医药出海不仅强调自身出海,还与中国药企合作出海,用我们的创新能力将其他企业的创新产品推向世界。”
“未来十年,我们希望成为一家源自中国的MNC(跨国公司),海外营收占比超过45%。我们的创新转型要进一步加快,创新药营收占比达到50%,创新管线必须保持在TOP 20%以内。”吴以芳补充道。
本文来自微信公众号“科创板日报”,作者:郑秉勋,36氪授权发布。

