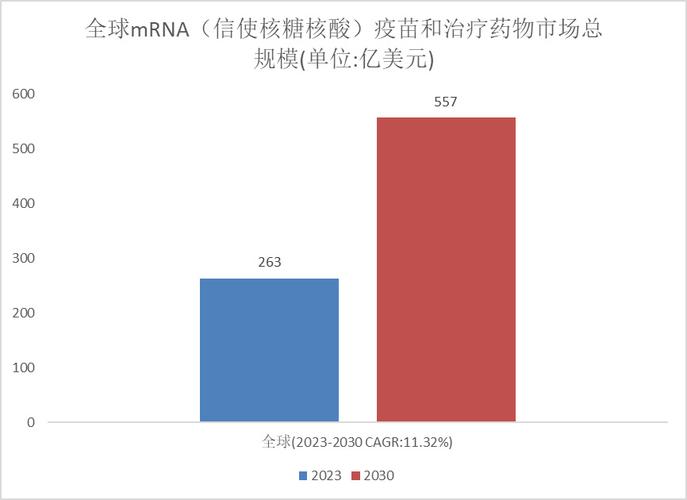
·咨询公司Frost & Sullivan预计,到2024年,全球抗过敏药物市场总规模将达到630亿美元(约合人民币4598亿元),中国市场将达到82亿美元(约合人民币5980亿元)。目前,过敏性疾病药物市场仍是一片“蓝海”。国内专注于自身免疫性疾病和过敏领域的创新药企约有20家。
连续打喷嚏、不停流泪、皮肤红痒、哮喘……全球约有20%至30%的人反复经历这些过敏症状。过敏的医学名称是“过敏”,当一个人的免疫系统对过敏原(一种对大多数人无害的物质)产生反应时就会发生过敏。过敏原多种多样,包括尘螨、宠物、花粉、昆虫、蜱虫、霉菌、食物和药物。它是一种全身性疾病,身体的所有器官都可能受到影响。
由于环境污染和现代生活方式的改变,本世纪初以来,过敏的发病率呈上升趋势。世界卫生组织(WHO)将过敏症列为21世纪重点研究和预防的三大疾病之一。对于医药行业来说,这是一个广阔的市场。
世界过敏组织(WAO)2011年发布的《WAO过敏白皮书》称,全球约有3亿人患有哮喘,220-5.2亿人患有食物过敏,4亿人患有过敏反应。鼻炎。中国疾病预防控制中心2023年发布的一项研究显示,我国40%的人受到过敏性疾病的困扰。咨询公司Frost & Sullivan预计,到2024年,全球抗过敏药物市场总规模将达到630亿美元(约合人民币4598亿元),中国市场将达到82亿美元(约合人民币598亿元)。元)。
目前,过敏性疾病药物市场仍是一片“蓝海”。国内专注于自身免疫性疾病和过敏领域的创新药企约有20家。 2024年12月27日,天辰生物制药(苏州)有限公司(以下简称“天辰生物”)联合创始人兼总经理刘恒博士在近期接受媒体采访时也表示:“过敏是一种相对较小但很美丽的疾病,“竞争格局相对友好,但临床需求巨大。”
许多过敏症无法通过标准治疗得到有效控制
WHO制定的过敏性疾病标准化治疗包括特异性免疫治疗、药物治疗、环境控制和患者健康教育四个方面。华中科技大学同济医学院附属同济医院变态反应科朱荣飞曾撰文,特异性免疫疗法又称脱敏疗法,在临床应用已有100多年的历史。是指将过敏原制成疫苗,通过反复皮下注射或舌下给药的方式给予患者,使患者对过敏原的耐受力逐渐增强。治疗后,当患者再次接触过敏原时,过敏症状不再出现或过敏症状减轻。然而,此类治疗的周期需要3-5年。规范的药物治疗可以有效减轻和控制过敏性炎症。例如,治疗过敏性鼻炎的鼻喷雾激素和治疗哮喘的吸入激素都是一线治疗方法。
时至今日,仍有许多过敏症患者的症状无法通过标准治疗得到有效控制。 2024年4月,抗过敏药物氯雷他定成为热搜话题,不少网友称其为“救命药”。然而,这些药物不能治愈过敏。从过敏原理来看,当外来过敏原进入体内时,免疫系统误将其视为敌人,释放大量免疫球蛋白E(IgE)、组胺等化学物质,引发炎症反应。氯雷他定等抗组胺药是对症治疗。脱敏治疗虽然效果持久,但耗时长、费用高且患者依从性不理想,导致治疗效果不如预期。我国目前只有尘螨、蒿花粉过敏相关制剂。
朱荣飞在文章中提到,针对过敏性炎症关键分子的生物靶向治疗和小分子药物治疗已成为当前过敏性疾病精准治疗的重要武器。例如,针对过敏的抗IgE单克隆抗体已被证明对过敏性鼻炎、哮喘具有良好的疗效和安全性。
全球第一代抗IgE单克隆抗体是奥马珠单抗,由美国生物技术公司Tanox开发。 2003年,美国食品和药物管理局(FDA)批准其上市用于治疗过敏性哮喘,随后又被批准用于治疗慢性自发性荨麻疹、慢性鼻窦炎伴鼻息肉和食物过敏。 2017年8月,奥马珠单抗(商品名:卓乐)获中国国家食品药品监督管理局批准上市,用于治疗中重度过敏性哮喘。后来适应症扩大到包括慢性自发性荨麻疹。奥马珠单抗已上市20多年,但尚未出现更有效的迭代药物。
天辰生物研发出新一代抗IgE单克隆抗体——LP-003,并于2024年2月在美国过敏、哮喘和自身免疫学会(AAAAI)年会上首次披露LP-003的不良反应标准治疗对照中重度季节性变应性鼻炎患者的II期临床试验数据显示,LP-003组在花粉高峰季节的鼻部症状总评分显着低于安慰剂组,不良事件发生率与安慰剂组相似。天辰生物此前的新闻稿称,本次II期临床试验结果显示,100毫克LP-003与300毫克第一代抗IgE抗体具有同等效果。
刘恒在接受采访时表示:“与已经上市的抗IgE单克隆抗体产品相比,我们产品的‘亲和力’(指药物与受体结合的能力)越大,亲和力就越大。” ,药物与受体结合越紧密,药效越强)增加约800倍,半衰期更长,可以支持更长期的给药,中美两国都有显着的依从性。患者去医院的时间很多,所以我们希望每季度给药一次,甚至每六个月给药一次,此外,这一代药物的安全性在自我使用方面更优越。免疫药物,无论是医生还是患者最关心的就是安全性。”
目前LP-003开发进度最快的适应症是过敏性鼻炎,处于III期临床试验阶段。预计2025年底或2026年初,公司将与CDE(国家药品监督管理局药品审评中心)沟通并提交Pre-BLA(生物制品许可申请)。荨麻疹和过敏性哮喘的适应症均处于二期临床试验,食物过敏的适应症也已获批IND(新药临床研究申请)。
“过敏性鼻炎是一个特别大的市场,虽然有些患者不需要治疗,但对于需要治疗的患者群体来说,现有的治疗方法只有鼻喷激素、鼻喷抗组胺药和口服抗组胺药。然而,上述治疗方法几乎没有根据我国荨麻疹治疗指南,早期使用抗组胺药,其次是抗组胺药奥马珠单抗也有效果。市场非常大,特别是南方潮湿炎热的地方,荨麻疹患者较多,尤其是女性患者。治疗哮喘的方法有很多,但吸入激素无法控制后,目前仍有创新的空间。生物制剂,特别是患者的依从性和医生对生物制剂的使用习惯方面。”刘恒说。
“即使是最大的制药公司也无法同时推广所有适应症和所有候选药物。总有一个优先事项。”刘恒告诉澎湃新闻。 “一般会从几个维度来考虑。第一是临床运营难度,第二是后端的商业推广。公司有广泛的规划,公司有配套的资源。”公开资料显示,过敏性鼻炎适应症奥马珠单抗已在日本获得批准,表明IgE靶点用于该适应症的可行性,而奥马珠单抗尚未获得批准。在中国申请该适应症。也就是说,天辰生物的LP-003有望成为国内抗IgE领域首个该适应症的创新药,并填补临床空白。
不到10%的疾病是可以治愈的
据刘恒介绍,天辰生物联合创始人孙乃超博士曾是Tanox联合创始人,也是奥马珠单抗的主要发明人之一。
LP-003的研发过程是否会因为奥马珠单抗的研发经验而变得更加容易? “从小分子化合物的角度来说,你可能有一个母核,可以不断完善。从抗体的角度来说,你的抗体序列可能是全新的,并没有在原来的抗体序列上进行优化,你可能要重新设计一个从头开始。”刘恒表示,开发新一代抗体药物和开发新型抗体药物面临着两个不同的问题。困境,“世界第一面临的问题可能是没有人接受,没有人理解。但如果想要成为下一代超越前者,每一步的进步都会更加困难。” “如果你面临一个巨大的项目,你必须首先将其拆分为许多小的、可操作的任务,然后将这些任务细化为每天或一段时间内可以完成的具体任务。”
天辰生物的另一个管线(药物开发项目)是双功能补体抑制剂LP-005,这也是孙乃超在Tanox时期就开始研发的技术。目前,该项目针对阵发性睡眠性血红蛋白尿症的研发已进入二期临床试验。补体系统是免疫系统的一部分,可以增强(补充)抗体和噬菌体细胞以消除病原体和受损细胞,并促进炎症攻击病原体细胞膜。补体可以起到保护作用,但也可以产生严重的负面影响。补体系统的过度激活或抑制在多种疾病的发病机制中发挥着重要作用。
阵发性睡眠性血红蛋白尿症是一种罕见疾病,是由于细胞表面的保护性蛋白CD55和CD59丢失,导致免疫系统开始攻击自身的红细胞,尿液会变成类似于酱油的颜色。
药企开发罕见病药物面临的一个共同问题是投资巨大,后续商业化利润可能无法覆盖成本。但刘恒认为,阵发性睡眠性血红蛋白尿的发病机制特别明确。 “人类疾病大约有6000种,其中只有不到10%可以用药物治疗。在这些可治疗的疾病中,许多药物的作用机制尚不清楚。对于药物开发来说,具有明确的作用机制是非常罕见的。”
据悉,2024年9月,天辰生物宣布完成近亿元B2轮融资,由启明创投领投,现有股东追加投资。制药行业曾流传“双十定律”,这意味着一款药物需要十年时间和十亿美元才能成功上市。如今,药品成本已远远超过“双十法”。 “对于全球任何一家生物科技公司来说,融资都是‘生命线’,公司的首要任务就是生存下来,尽快实现第一个盈亏平衡点。”刘恒说道。
参考:
1.王进一,孙明伟,李国兴,尹大鹏,胡驰,孙金芳。关键词: 过敏性疾病, 门诊患者, 人群分布, 年龄性别分布, 湖北省宜昌市, 2018-2021年中国疾病预防控制中心周刊, 2023, 5(31): 681-686.
2.
3.? id=1732711674005056295&wfr=蜘蛛&for=pc

