·1999年,威尔逊启动了针对OTC缺陷的基因治疗的临床试验。一名 18 岁患者杰西·基辛格 (Jesse Gelsinger) 参加了试验,但在接受治疗 8 天后死亡。由于该患者的死亡是由基因治疗直接导致的,美国食品药品监督管理局在调查后终止了大量相关研究,并禁止威尔逊在五年内进行基因治疗研究。这个领域已经沉寂了20多年。
当地时间2025年1月9日,美国生物技术公司iECURE宣布,其用于治疗鸟氨酸转氨甲酰酶(OTC)缺乏症的体内基因编辑疗法ECUR-506在首例婴儿患者中取得了显着效果。安全性很好。 ECUR-506据说是美国第一个批准用于婴儿研究的体内基因编辑疗法。
根据 iECURE 的新闻稿,OTC 缺乏症是一种严重的罕见遗传性疾病,其中氨(人体分解蛋白质时产生的废物)在血液中积聚。高浓度的氨对大脑有毒。新生儿发病的 OTC 缺乏症患者在出生后不久就会出现高氨血症症状,包括嗜睡、吸吮能力差和呕吐。如果不及时治疗,这些症状可能会迅速发展为癫痫、脑损伤、昏迷,甚至死亡。全球每年约有 1,000 名婴儿患有这种疾病。
将新生儿从第一次高氨血症危机 (HAC) 中拯救出来通常需要透析和静脉注射氨清除剂药物。一旦婴儿稳定,继续医疗管理,包括氨清除剂和蛋白质限制。尽管进行药物治疗,仍可能发生额外的高氨血症危象,因此临床医生建议患者在生命的第一年接受肝移植。肝移植虽然可以治愈OTC缺乏症,但存在移植失败的风险,长期使用免疫抑制剂还可能增加恶性肿瘤和感染的风险。
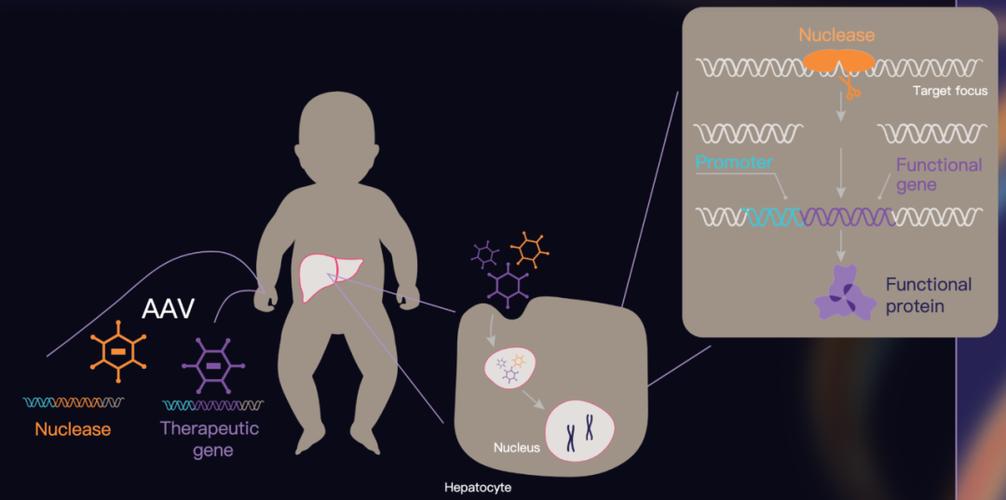
iECURE 开发的实验性基因编辑疗法通过两种腺相关病毒 (AAV) 载体进行传递。它包含两种载体,一种在充分表征的 PCSK9 基因座上提供 ARCUS 核酸酶靶向基因编辑;另一种在特征明确的 PCSK9 基因座上提供 ARCUS 核酸酶靶向基因编辑。另一个传递所需的功能性 OTC 基因。 ECUR-506 编辑患者的基因组,使用 ARCUS 核酸酶在安全位点切割 DNA,然后让病毒引入正确基因的新副本。
根据iECURE披露的信息,试验中的男婴在出生第一周经历了高氨血症危机,随后被诊断为新生儿发病的OTC缺乏症。他的病情通过血液透析稳定下来,同时接受标准的氨清除。药物和蛋白质限制疗法。 3.5 个月时,尽管遵循限制蛋白质饮食并使用清除药物,患者仍经历了高氨血症危机。
6.5 个月大时,男孩接受了单次输注最低剂量的 ECUR-506,并且总体耐受性良好。 4周后的常规实验室检查显示无症状转氨酶升高,6周时的肝活检显示急性T细胞炎症反应,免疫抑制治疗后8周恢复正常。根据血清谷氨酰胺水平的下降,患者逐渐停用氨清除药物,并在12周后完全停用。与此同时,患者的蛋白质摄入量增加至适合年龄的水平,平均氨水平和血清谷氨酰胺水平保持正常,并且他没有经历进一步的高氨血症危机。该患者现已转入长期随访研究,并接受持续监测。 iECURE 表示,该患者的六个月数据将于 2026 年上半年发布。
需要注意的是,这项试验还处于非常早期的阶段,样本量只有1个。生物医药行业媒体Endpoints News在当地时间2025年1月11日的报道中指出:治疗效果的持久性仍然是最重要的。最大的未知数,iECUR尚未证实治疗效果是由于基因编辑整合到婴儿基因组中所致。安全性也可能仍然是一个问题——男婴在接受输注一个月后,血液中的肝酶水平急剧升高。然而,服用免疫抑制药物后,他在一个月内康复了。
ECUR-506 由基因治疗先驱 James Wilson 开发。 1999年,威尔逊就已经启动了针对OTC缺陷的基因治疗的临床试验。一名 18 岁患者杰西·基辛格 (Jesse Gelsinger) 参加了试验,但在接受治疗 8 天后死亡。由于该患者的死亡是由基因治疗直接导致的,美国食品药品监督管理局在调查后终止了大量相关研究,并禁止威尔逊在五年内进行基因治疗研究。这个领域已经沉寂了20多年。

