KRAS是癌症中极其常见的“问题蛋白”,大约四分之一的人类肿瘤中存在KRAS突变。这种突变可以使细胞无限增殖并引发癌症。尽管相关突变非常常见且有害,但目前FDA批准的专门针对KRAS突变的药物只有两类,而且只能在一定程度上延长患者的生存期。对于许多癌症患者来说,新的 KRAS 疗法需要更大的益处。
近日,在《Nature Biotechnology》发表的研究中,INSILICO Medicine、加拿大多伦多大学、圣玉儿童研究医院等科研机构推出了“量子计算+经典计算+一代AI”。跨界合作,尝试设计针对“非药物”KRAS的新型抑制剂分子。

该研究首次展示了量子计算结合AI在药物早期发现中的潜在优势,为高难度靶点的治疗方案带来新的希望。
01 量子计算+AI,如何构建药物分子生成流程
研究团队提出了量子经典混合生成框架:结合**量子变分生成模型(QCBM)和长短期记忆网络(LSTM)**来协同设计新分子。具体来说,他们使用包含 110 万种分子的定制数据集来“训练”量子经典混合模型。这个巨大的数据源包括:
文献中已证实可阻断KRAS的650个分子,
使用 Stoned-Selfies 算法源自已知 KRAS 抑制剂的 850,000 种像素,
虚拟筛选平台通过virtualflow获得25万种元素。
如此丰富的训练数据让量子经典混合模型能够学习到更广阔的“化学空间”,为后续多样化候选奠定了基础。
接下来是量子与经典协同的过程。
在这组量子经典混合模型中,
QCBM:作为量子生成模型,利用量子电路学习复杂的概率分布,并生成与训练数据类似但“尚未探索”的分子结构。它还充当引导 LSTM 分子序列的“先验”。
LSTM:经典AI模型的优点是可以理解并生成序列数据。通过引入QCBM输出的概率分布,LSTM在生成新的化学结构时可以更准确地掌握分子多样性,避免对熟悉结构的过度拟合或收敛。
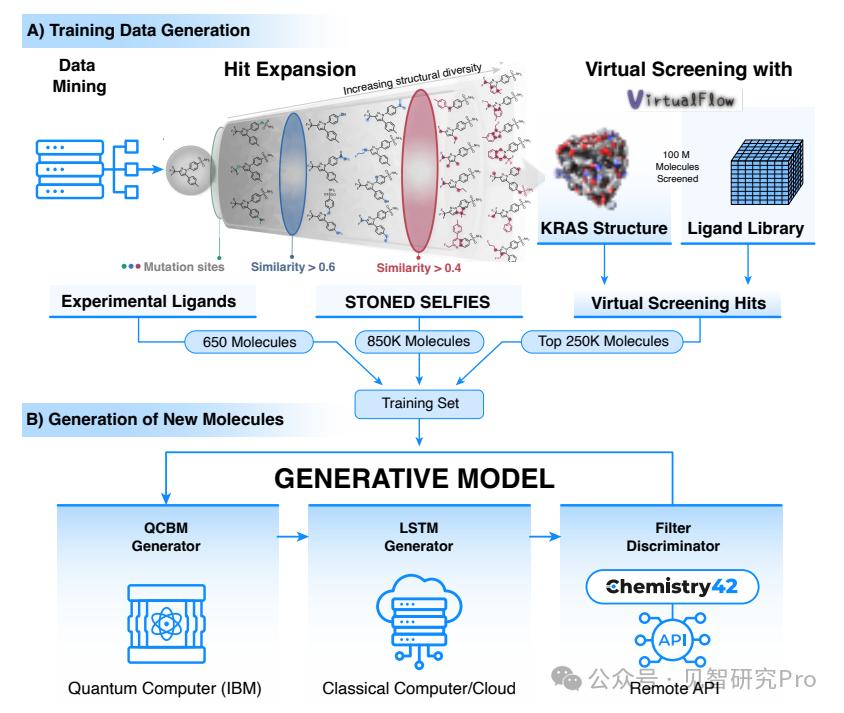
在实际应用中,研究团队首先使用混合模型一次性生成了100万个候选。然后,借助英思利智能自主研发的Chemistry42生成的人工智能引擎,他们对这些分子进行了系统的评估和筛选,包括类药性、互联分数、合成可利用性等多个维度。有潜力的候选人进入实验室测试。
02 从云筛选到实验验证
与传统的药物发现相比,该方法不需要依赖大规模的物理化合物库来进行昂贵且冗长的高通量过滤。相反,大部分筛选工作都可以在云端完成,大大降低了成本和时间。在最后的实验室阶段,对这15个都道府县进行了“湿实验”测试。
其中,名为ISM061-018-2的分子具有很强的靶向KRAS活性,并且没有表现出明显的细胞毒性。同时,它具有野生KRAS和多种常见突变KRAS(以及野生HRAS和NRAS)的潜力,显示出成为“泛RAS抑制剂”的潜力。
另一种分子ISM061-022对一些突变型KRAS(如G12R和Q61H)表现出更高效的抑制作用,也有望发展成为广谱抗癌药物的候选药物。
值得注意的是,目前的研究无法证明这种量子经典混合方法比纯经典方法“更好”,但至少表明量子计算在药物早期发现方面具有可行性和潜在加速作用。随着量子计算硬件的不断升级,其在生产模式中的应用前景也将相应扩大。
多伦多大学化学和计算机科学教授 Alán Aspuru-Guzik 博士表示:“这是一项原理验证的研究。它初步表明量子计算机可以融入现代人工智能驱动的药物研发流程,并成功设计出能够与生物靶标结合的活性分子,虽然“量子计算相对于经典方法的绝对优势”尚未显现,但随着量子硬件能力的增强,我们希望相关算法能够得到应用。会变得越来越多
在取得KRAS成功的早期成果后,研究团队计划将这套量子经典混合模型推广到更多“非医学”蛋白质靶点。与 KRAS 类似,这些含有小蛋白质且缺乏可与化合物稳定的表面的“口袋”一直是药物开发中最困难的目标之一。研究人员还将继续优化KRAS标志的KRAS标志,并在动物模型中进行验证,力争为癌症患者带来更有效的新一代元素。
英思科技创始人兼首席执行官ALEX Zhavoronkov博士表示:“多达85%的人类蛋白质被认为是来自这些蛋白质的‘可能性’,这一直是抗癌研究的挑战。智能正好可以在这个困难上展现出独特的力量。”骨。
03 量子与AI融合前景广阔
事实上,这并不是智能大学与多伦多大学的第一次“联合”。早在2023年,他们就在Journal of Chemical Information and Modeling上发表了第一篇合作论文。通过多个实验场景,将它们改为经典生成模型Molgan的不同部分,讨论量子生成对抗。网络在小分子药物发现中的应用。
Nature BioteChnology最新发表的结果再次证实了量子计算在药物设计阶段的潜在价值。随着量子计算技术与AI生成模型的进一步结合,未来或许能够针对那些“困难目标”筛选活性分子,为更多患者带来希望。
虽然目前量子计算已经超越了经典算法,但英科智能作为人工智能医药领域的领先探索者,正在积极寻求量子计算与人工智能结合的方法,以便在量子计算技术落地时取得先发优势。制成。这一想法也呼应了国际上对AI药物研发的乐观预期。
诺贝尔奖获得者、谷歌 DeepMind 首席执行官 Demis Hassabis 近日在达沃斯世界经济论坛上表示,今年年底前,基于 AI 的药物有望进入临床试验。
这些药物由 Alphabet 的同构实验室开发,旨在从第一原理出发重塑药物发现过程。哈萨比斯指出,Alphafold技术已成功预测2亿个蛋白质结构,为精准研发提供了前所未有的可能性。
在此背景下,更多的科研机构、初创公司和大型跨国制药公司正在不断探索人工智能和量子计算等前沿技术的结合。 AI不仅可以帮助科学家从巨大的分子空间中快速筛选出潜在的候选者,还可以进一步利用量子计算强大的计算能力,找到满足“非医学”目标需求的新的分子设计思路。
本文来自微信公众号“智研Pro”。

