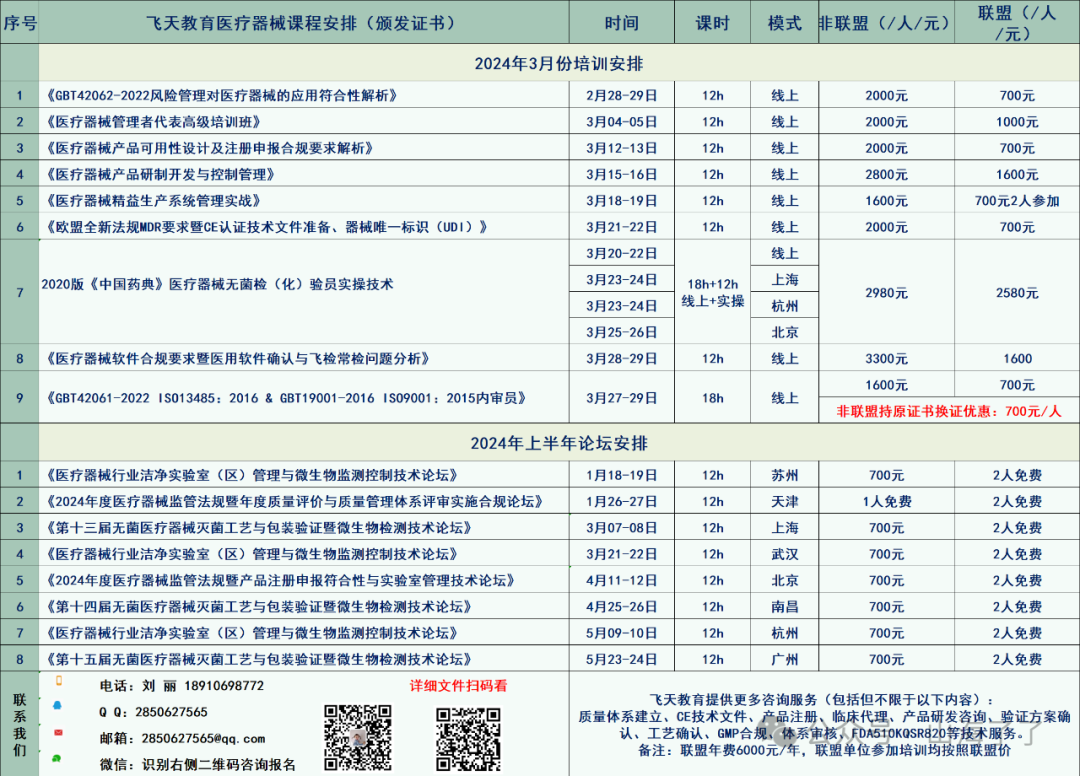
《医疗器械软件合规要求暨软件确认与飞检常检问题分析》
2024年3月28-29日 线上直播
会议费3300元/人;联盟企业1600元/人(含资料、证书费)
自《医疗器械生产质量管理规范》施行以来,监管部门陆续发布了无菌医疗器械、植入性医疗器械、体外诊断试剂的附录文件。2019年7月国家药监局进一步补充和完善了《规范》的技术文件体系,发布了《医疗器械生产质量管理规范附录独立软件》,对加强独立软件类医疗器械生产监管,规范独立软件生产质量管理提出新的合规要求。2022年3月9日国家药监局器审中心发布了《医疗器械软件注册技术审查指导原则》(2022年修订版),用于指导医疗器械软件生存周期过程和准备医疗器械软件注册申报资料,为医疗器械软件、质量管理软件的体系核查提供参考。
随着软件地位提高,软件的可靠性逐步成为业界关心的问题。一旦软件运行失效,将导致医疗器械运行失常,延误诊断、错误治疗,甚至导致患者的严重伤害或死亡。鉴于此,飞天教育特举办“医疗器械软件合规要求暨软件确认与飞检常检问题分析”专题会议,讨论如何开展软件确认活动,以确保软件始终按照预期来运行,诚邀贵单位参加。
01
会议内容
1、医疗器械软件网络安全、注册技术审查《指导原则》解析;
2、《医疗器械生产质量管理规范附录独立软件》合规要求及相关飞检案例分析;
3、医疗器械软件开发计划、测试计划、检验计划(含SOUP特定要求);
4、GB/T42061-2022在医疗设备软件的质量管理系统中的应用;
5、ISO14971:2019 对医疗设备软件的风险管理要求新变化;
6、医疗器械设备软件注册申报案例分析;
7、医疗器械设备软件描述文档编写规范;
8、医疗器械设备软件的确认及方法要求;
9、讨论与答疑。
02
讲师介绍
届时将邀请从事数字医疗产品检测/标准研究工作、担任科技部国家重点研发计划“数字诊疗装备研发”项目评审的专家,结合医疗器械软件、网络安全、人工智能等领域质量评价工作经历,研讨相关合规路径与解决方法。
03
组织方式
1、直播平台:腾讯会议
2、会议时间:2024年3月28-299日(2天,12学时)
3、会议费用:非联盟企业3300元/人,联盟企业1600元/人
0403
参会对象
Ø医疗器械医疗器械监管机构、技术支持机构等相关工作人员。
Ø医疗器械企业从事生产、研发、注册的人员、技术部长、注册文件编写人员等。
Ø医疗器械企业负责验证和确认工作的人员等。
05
报名详询:
刘老师:18910698772
扫描下方二维码咨询报名

扫描下方二维码获取文件

06
近期课程表